Гемосорбент «ЛПС-Гемо» применение

к.м.н., доц. И. М. Ровдо
Белорусский государственный медицинский университет. Минск
В начале нового тысячелетия сепсис по-прежнему остается одной из самых актуальных проблем современной медицины в силу неуклонной тенденции к росту заболеваемости и стабильно высокой летальности. По мировым данным ежегодно диагностируют более 700 тыс. случаев заболевания тяжелым сепсисом, т. е. около 2000 случаев ежедневно.
Клиническая эффективность гемосорбента "ЛПС-ГЕМО"

А.В.Старостин, В.Н.Гапанович, В.В.Кирковский, В.П.Голубович, И.М.Ровдо, Г.А.Лобачева
В последние десятилетия в развитых странах отмечается отчетливая динамика роста заболеваемости сепсисом. Несмотря на непрерывное совершенствование методов интенсивной терапии и наличие постоянно увеличивающегося спектра антибиотиков, септические осложнения являются наиболее частыми причинами смерти пациентов в ОИТР.
Эфферентные методы в терапии панкреонекроза
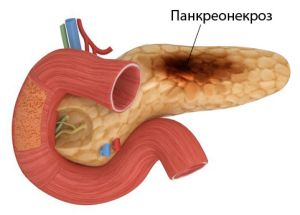
В.Г.Васильков, А.В.Нестеров, М.Ф.Купцова, Т.В.Чернова, В.А.Бегунов, В.В.Васильков
ГОУ ДПО ПИУВ Росздрава, Пенза
Цель: Оценить эффективность сочетанного применения: гемосорбции биоспецифическим антипротеиназным гемосорбентом "Гемо-Протеазсорб®" («Овосорб»), интестинального введения мафусола; комплексного парентерального и раннего энтерального питания больным панкреонекрозом.
Применение гемосорбента Анти-IgE-Гемо при бронхиальной астме
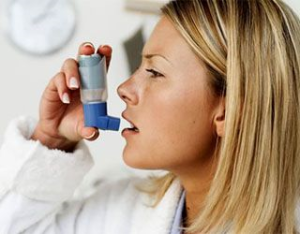
К.м.н., доцент И.М. Ровдо
Белорусский государственный медицинский университет. Минск
Предложенный способ лечения больных бронхиальной астмой основанный на применении биоспецифического гемосорбента "Анти-IgE-Гемо®". Показано, что включение биоспецифической гемосорбции на гемосорбенте "Анти-IgE-Гемо®" в комплексную терапию больных с бронхиальной астмой оказывает значительно более выраженный положительный эффект на клинико-лабораторный статус и показатели функции внешнего дыхания, чем традиционная медикаментозная терапия
"Гемо-протеазсорб" и провоспалительные цитокины
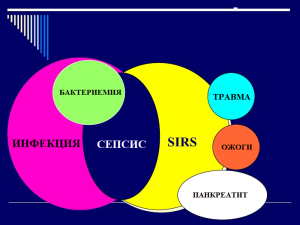
Р.Э. Якубцевич, к.м.н.; В.В. Спас, д.м.н., профессор; А.В. Максименко; Р.А. Анисим; Н.Е. Торяник; О.Н. Бородавко; Т.Э. Янулевич
УО «Гродненский государственный медицинский университет» УОЗ «Гродненская областная клиническая больница»
ВОЗМОЖНОСТИ ЭЛИМИНАЦИИ ЦИТОКИНОВ У БОЛЬНЫХ СЕПСИСОМ С ПОМОЩЬЮ ЭКСТРАКОРПОРАЛЬНЫХ МЕТОДОВ ОЧИЩЕНИЯ КРОВИ
Изучен уровень про- и противовоспалительных цитокинов у 57 пациента с сепсисом различной этиологии и тяжестью состояния по APACHE II 22,3±4,8 баллов, которым в комплекс интенсивной терапии включили мероприятия экстракорпорального очищения крови (гемосорбция через "Гемо-протеазсорб®"("Овосорб"), гемокарбоперфузия через «Симплекс-Ф», плазмаферез или high-flux диализ). В результате установлено, что методы экстракорпорального очищения крови способны эффективно снижать избыток провоспалительных цитокинов, не уменьшая концентрацию противовоспалительных.
Экстракорпоральная фармакотерапия при абдоминальном хирургическом сепсисе
Авторы Сажин В.П., Климов Д.Е., Голубенко В.Л., Новомосковск, Рязань
Кафедра хирургии и ОВП с курсом эндохирургии ФПДО РязГМУ им. акад. И.П. Павлова
Новомосковская городская клиническая больница.
Аннотация. В исследовании приведены результаты лечения 28 больных с распространенным перитонитом различной этиологии. В этой группе больных в комплексе терапии проводился курс экстракорпоральной (гемосорбент "Гемо-Протеазсорб®") фармакотерапии антибактериальными препаратами.
Целью исследования явилось улучшение результатов лечения больных перитонитом.
Мнение специалиста Витебск. Беларусь

Рецензия на гемосорбенты ГЕМО-ПРОТЕАЗСОРБ, ЛПС-ГЕМО, АНТИ IgE-ГЕМО
Отделение гемосорбции и гравитационной хирургии крови Витебской областной клинической больницы является основным клиническим центром применения метод экстракорпоральной коррекции гомеостаза Витебской области.
Мнение специалиста: гемосорбенты

Отзыв на гемосорбенты ведущего специалиста Гомельской областной клинической больницы. Беларусь.
Мнение специалиста РФ: Протеазсорб-Гемо

Отзыв на гемосорбент Протеазсорб-Гемо. Российская Федерация.
Биоспецифическая сорбция - способ лечения атопического дерматита
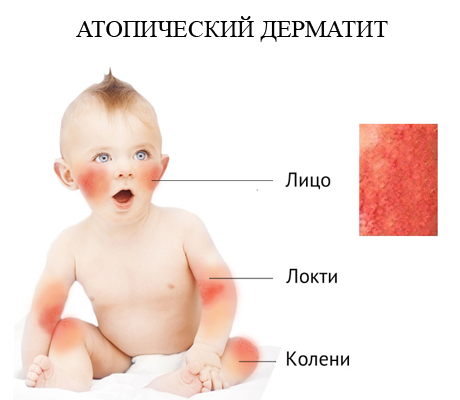
Поплавская Н.Б.
УО "Белорусский государственный медицинский университет" Минск
Биоспецифическая гемосорбция как способ патогенетического лечения атопического дерматита
В статье представлен опыт лечения атопического дерматита с применением биоспецифического сорбента "Анти-IgE-Гемо®"
Панкреатит – комплексное лечение с применением гемосорбента «Гемо-протеазсорб»
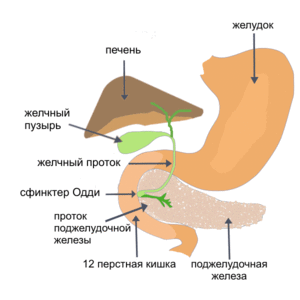
д.м.н. Кирковский В.В. Белорусский государственный медицинский университет. Минск
Панкреатит — это заболевания и синдромы, которые возникают при воспалении поджелудочной железы. Начиная с первых суток, с момента госпитализации пациента, с установленным диагнозом панкреатит, этиопатогенетически показано применение в комплексной терапии гемосорбции на гемосорбенте «Гемо-Протеазсорб®».
Гнойный перитонит - основное показание применения сорбента "ЛПС-Гемо"

д.м.н. Кирковский В.В. Белорусский государственный медицинский университет. Минск
Гнойный перитонит — воспаление брюшины, сопровождающееся местными изменениями брюшинного покрова и общей реакцией организма, вызванной гнойной интоксикацией. Специфическое удаление сорбентом "ЛПС-ГЕМО®" микробных тел и клеточной стенки грамотрицательных микроорганизмов, являющихся основным патогенетическим звеном развития заболевания ( кишечная палочка, менингококки, гонококки и др.) в совокупности с проводимым комплексным лечением дает отличный клинический эффект.
Инструкция по применению системы "Суфокоп"

Назначение системы "Суфокоп"
Система "Суфокоп" предназначена для проведения ультрафиолетового облучения крови в аппарате "Гемоквант04".
Инструкция на сорбент "Гемо-Протеазсорб"

Инструкция по применению сорбента "ГЕМО-ПРОТЕАЗСОРБ®"
"ГЕМО-ПРОТЕАЗСОРБ®" предназначен для избирательного удаления протеолитических ферментов из крови, плазмы и других биологических жидкостей с целью нормализации нарушенного в ходе развития патологического процесса баланса в системе протеиназы-ингибиторы и устранения негативных патофизиологических эффектов гиперферментемии за счет селективного извлечения активированных форм сериновых протеиназ.
Инструкция по применению гемосорбента "ЛПС-Гемо"

Назначение гемосорбента "ЛПС-ГЕМО®"
Гемосорбент «ЛПС-ГЕМО®» предназначен для избирательного удаления из крови, плазмы бактериальных липополисахаридов и представляет собой полимерную матрицу с иммобилизованным лигандом антибиотиком – Полимиксин.
Инструкция по применению гемосорбента "Анти-IgE-Гемо"

Назначение гемосорбента "АНТИ-IgE-ГЕМО®"
Гемосорбент «АНТИ-IgE-ГЕМО®» представляет собой полимер, с иммобилизованными в нем биоспецифическим лигандом, расфасованный в однократного применения модуль массообменный для гемосорбции ММГ. Предназначен для избирательного удаления иммуноглобулинов Е и G из крови с целью десенсибилизации организма при аллергических заболеваниях.
Инструкция по применению гемосорбента "Антилипопротеид"

Назначение гемосорбента "Антилипопротеид®"
Гемосорбент «Антилипопротеид®» представляет собой полимер, с иммобилизованными в нем биоспецифическим лигандом, расфасованный в однократного применения модуль массообменный для гемосорбции ММГ. Предназначен для избирательного удаления атерогенных липопротеинов при гиперхолестеринемии и дислипидемии.
Свидетельство о регистрации НП ОДО "Фармавит"

Регистрационное удостоверение "ГЕМО-ПРОТЕАЗСОРБ"

Регистрационное удостоверение "ЛПС-ГЕМО"

Регистрационное удостоверение "АНТИ-IGE-ГЕМО"

Регистрационное удостоверение "Суфокоп"

Регистрационное удостоверение "ГЕМОСБЕЛ"

